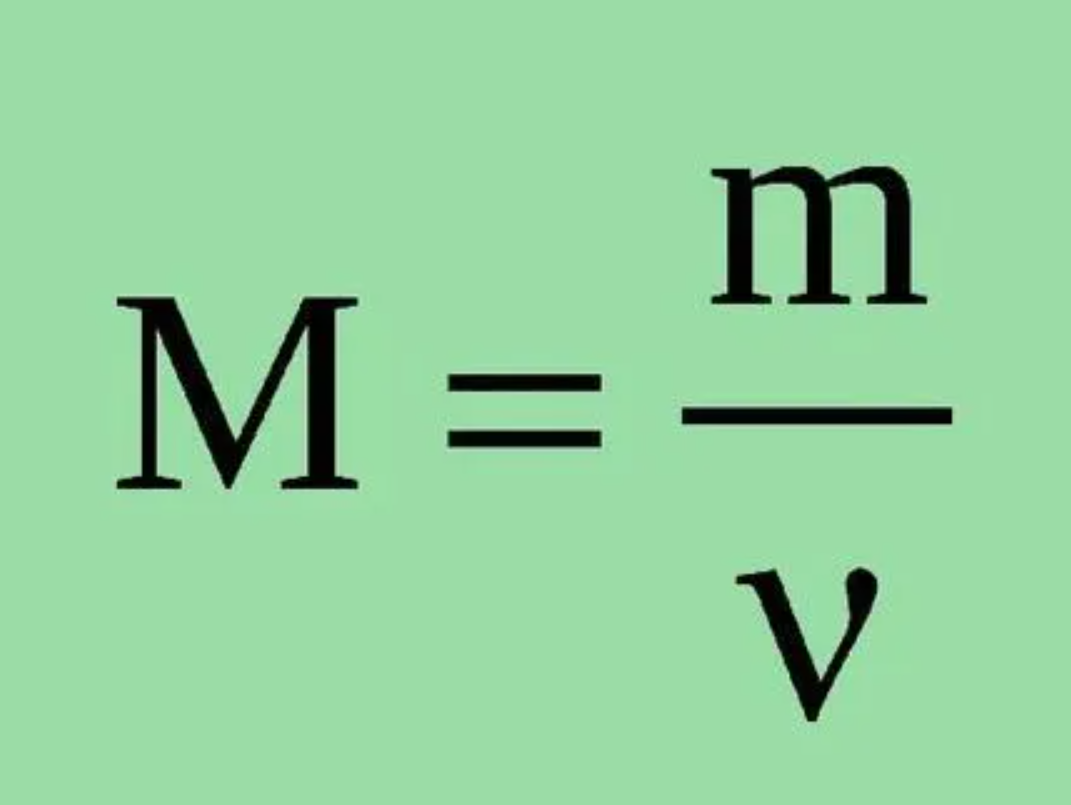Маса речовини — це ключ до розуміння багатьох процесів у природі, техніці та повсякденному житті. Чи то в лабораторії, на кухні, чи в інженерному проєкті, вміння точно визначити масу відкриває двері до нових знань і можливостей. У цій статті ми розберемо, як знайти масу речовини, крок за кроком, з яскравими прикладами та глибокими поясненнями, щоб кожен — від школяра до професіонала — міг освоїти цю тему.
Що таке маса речовини та чому вона важлива?
Маса — це фізична величина, яка показує, скільки матерії міститься в об’єкті чи речовині. Вона вимірюється в кілограмах (кг) у системі СІ, але в побуті часто використовують грами (г) чи міліграми (мг). На відміну від ваги, яка залежить від гравітації, маса завжди стала — чи то на Землі, чи на Місяці.
Чому маса важлива? Вона лежить в основі розрахунків у хімії, фізиці, кулінарії, фармацевтиці та навіть космічних технологіях. Наприклад, у хімії маса речовини потрібна для правильного змішування реагентів, а в інженерії — для розрахунку міцності конструкцій. Без знання маси неможливо точно дозувати ліки чи готувати ідеальний рецепт.
Відмінність між масою та вагою
Маса — це кількість матерії, а вага — це сила, з якою ця матерія притягується до Землі. Вага може змінюватися залежно від гравітації, але маса завжди однакова. Наприклад, астронавт на Місяці важить менше, але його маса залишається незмінною. Щоб уникнути плутанини, у науці завжди говорять про масу, коли мають на увазі кількість речовини.
Основні методи визначення маси речовини
Існує кілька способів знайти масу речовини, і кожен з них має свої особливості. Ми розглянемо найпоширеніші методи, пояснимо їхню суть і дамо практичні поради для використання.
Пряме вимірювання за допомогою ваг
Найпростіший і найпоширеніший спосіб — зважування. Ваги бувають механічні, електронні, аналітичні, і кожні мають свою точність. Наприклад, кухонні ваги підходять для зважування продуктів, а аналітичні — для точних лабораторних вимірювань.
Ось як правильно виміряти масу речовини на вагах:
- Калібрування ваг. Перед початком переконайтеся, що ваги показують нуль. Якщо це електронні ваги, увімкніть їх і дочекайтеся стабілізації показників.
- Підготовка зразка. Помістіть речовину в контейнер (якщо це порошок чи рідина) або безпосередньо на платформу ваг.
- Тара. Якщо використовуєте контейнер, спочатку зважте його порожнім і відніміть цю масу від загального результату. Більшість сучасних ваг мають функцію “тара”, яка автоматично враховує вагу посуду.
- Запис результату. Запишіть масу з урахуванням одиниць вимірювання (кг, г, мг). Для точності повторіть вимірювання 2–3 рази.
Після зважування перевірте, чи відповідає результат вашим очікуванням. Наприклад, якщо ви зважили 100 мл води, маса має бути приблизно 100 г, адже густина води — 1 г/см³. Якщо результат значно відрізняється, можливо, ваги потребують повторного калібрування.
Обчислення маси через об’єм і густину
Якщо ви не можете зважити речовину безпосередньо, масу можна знайти за формулою:
m = ρ × V,
де m — маса (кг), ρ — густина (кг/м³), V — об’єм (м³).
Цей метод ідеально підходить для рідин, газів чи однорідних твердих тіл. Наприклад, щоб знайти масу 2 літрів молока, знаючи, що густина молока становить 1,03 г/см³, виконайте такі кроки:
- Переведіть одиниці. 2 літри = 2000 см³.
- Підставте в формулу. m = 1,03 г/см³ × 2000 см³ = 2060 г = 2,06 кг.
- Перевірте результат. Для молока маса в 2,06 кг для 2 літрів виглядає логічно.
Важливо знати точну густину речовини, адже вона може варіюватися. Наприклад, густина морської води вища, ніж прісної, через вміст солей. Таблиці густин можна знайти в довідниках або на сайтах, таких як chem.libretexts.org.
Визначення маси через хімічні реакції
У хімії масу речовини часто визначають через реакції, де відомі співвідношення реагентів і продуктів. Наприклад, якщо ви знаєте молярну масу речовини та кількість молей, масу можна знайти за формулою:
m = n × M,
де m — маса (г), n — кількість молей, M — молярна маса (г/моль).
Приклад: вам потрібно знайти масу 0,5 моль кухонної солі (NaCl). Молярна маса NaCl = 58,44 г/моль. Підставимо: m = 0,5 × 58,44 = 29,22 г.
Цей метод вимагає знання стехіометрії та точних вимірювань, але він незамінний у лабораторіях, де пряме зважування неможливе.
Інструменти для вимірювання маси
Вибір інструменту залежить від типу речовини та потрібної точності. Ось порівняння основних типів ваг у таблиці:
| Тип ваг | Точність | Застосування | Ціна (приблизно) |
|---|---|---|---|
| Механічні | ±1 г | Побут, торгівля | Низька |
| Електронні кухонні | ±0,1 г | Кулінарія, дрібні вимірювання | Середня |
| Аналітичні | ±0,0001 г | Лабораторії, фармацевтика | Висока |
Джерело: інформація зібрана з довідників фізичних приладів та сайту sigmaaldrich.com.
Для точних вимірювань у лабораторіях використовують аналітичні ваги, які враховують навіть найдрібніші частинки. У побуті достатньо електронних кухонних ваг із точністю 0,1 г.
Типові помилки при визначенні маси
Типові помилки та як їх уникнути
- 🚫 Неправильне калібрування ваг. Завжди перевіряйте нульовий показник перед зважуванням. Некалібровані ваги можуть додавати або віднімати кілька грамів, що критично для точних вимірювань.
- ⚖️ Ігнорування тари. Якщо ви зважили речовину разом із контейнером і не врахували його масу, результат буде неточним. Використовуйте функцію “тара” або відніміть масу посуду вручну.
- 🌬️ Вплив зовнішніх факторів. Вітер, вібрації чи нерівна поверхня можуть спотворити показники. Ставте ваги на стабільну поверхню та уникайте протягів.
- 📏 Неправильний вибір одиниць. Переконайтеся, що ви використовуєте потрібні одиниці (г, кг, мг). Наприклад, у лабораторіях часто потрібні міліграми, а не грами.
- 🧪 Помилки в розрахунках густини. Якщо ви використовуєте формулу m = ρ × V, перевірте, чи правильна густина для вашої речовини. Наприклад, густина етанолу нижча, ніж води, і це може вплинути на результат.
Практичні приклади з різних сфер
У хімії
У лабораторії ви готуєте розчин із 0,2 моль сульфату натрію (Na₂SO₄). Молярна маса Na₂SO₄ = 142 г/моль. Маса = 0,2 × 142 = 28,4 г. Зважте цю кількість на аналітичних вагах, щоб отримати точний розчин.
У кулінарії
Ви готуєте торт і хочете знати масу 500 мл вершків із густиною 1,02 г/см³. Маса = 1,02 × 500 = 510 г. Використайте кухонні ваги для перевірки.
У промисловості
Інженер розраховує масу сталевої балки об’ємом 0,05 м³. Густина сталі — 7850 кг/м³. Маса = 7850 × 0,05 = 392,5 кг. Цей розрахунок потрібен для оцінки міцності конструкції.
Як підвищити точність вимірювань
Точність — це ключ до надійних результатів. Ось кілька порад:
- Використовуйте ваги з відповідною точністю. Для лабораторій — аналітичні, для кухні — електронні.
- Уникайте зовнішніх впливів: протягів, вібрацій, магнітних полів.
- Перевіряйте густину речовини в довідниках, адже вона може залежати від температури чи домішок.
- Повторюйте вимірювання 2–3 рази для підтвердження результату.
Ці прості кроки допоможуть уникнути помилок і отримати дані, яким можна довіряти.
Цікаві факти про масу речовини
Цікаві факти про масу
- 🌌 Маса у космосі. У невагомості масу вимірюють за допомогою спеціальних пружинних пристроїв, які оцінюють інерцію об’єкта, а не вагу.
- ⚖️ Еталон кілограма. До 2019 року кілограм визначався за фізичним еталоном — платиновим циліндром у Парижі. Тепер він базується на фундаментальній сталій Планка.
- 🧬 Маса молекул. Сучасні мас-спектрометри можуть вимірювати масу окремих молекул із точністю до атомних одиниць маси.
- 🌍 Маса Землі. Маса нашої планети становить приблизно 5,972 × 10²⁴ кг. Її визначили через гравітаційні вимірювання.
- 💧 Маса води. Один літр чистої води при 4°C важить точно 1 кг — це основа метричної системи.
Ці факти показують, наскільки багатогранною є концепція маси — від мікроскопічних молекул до цілих планет.
Як обрати правильний метод для вашої задачі
Вибір методу залежить від контексту. Якщо ви працюєте в лабораторії, використовуйте аналітичні ваги або хімічні розрахунки. Для побутових потреб достатньо кухонних ваг. Якщо речовина недоступна для зважування, скористайтеся формулами з густиною чи молярною масою.
Пам’ятайте: точність і уважність — ваші найкращі помічники. Перевіряйте інструменти, враховуйте умови вимірювання та не бійтеся перепитати довідники. Знання маси речовини — це не просто цифра, а ключ до розуміння світу навколо.